Dažnai susiduriama su sunkumais sprendžiant, kuris elektrodas yra katodas, o kuris - anodas. Pirmiausia reikėtų apibrėžti sąvokas.
Turinys
Katodo ir anodo sąvokos - paprastas paaiškinimas
Sudėtingose medžiagose elektronai tarp junginių atomų pasiskirsto nevienodai. Dėl sąveikos dalelės juda iš vienos medžiagos atomo į kitos medžiagos atomą. Ši reakcija vadinama oksidacijos-redukcijos reakcija. Elektronų praradimas vadinamas oksidacija, o elektronus atiduodantis elementas vadinamas reduktoriumi.
Elektronų pridėjimas vadinamas redukcija, o elektronus priimantis elementas - oksidatoriumi. Elektronai iš reduktoriaus į oksidatorių gali būti perduodami per išorinę grandinę, o tada jie gali būti naudojami kaip elektros energijos šaltinis. Prietaisai, kuriuose cheminės reakcijos energija paverčiama elektros energija, vadinami galvaniniais elementais.
Paprasčiausias klasikinis galvaninio elemento pavyzdys - dvi plokštės, pagamintos iš skirtingų metalų ir panardintos į elektrolito tirpalą. Šioje sistemoje vienas metalas oksiduojasi, o kitas redukuojasi.
SVARBU! Elektrodas, kuriame vyksta oksidacija, vadinamas anodu. Elektrodas, kuriame vyksta redukcija, vadinamas katodu.
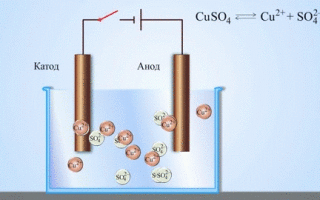
Vario ir cinko galvaninis elementas, veikiantis absorbuojant cinko ir vario sulfato reakcijos energiją, yra gerai pažįstamas pavyzdys iš mokyklinių chemijos vadovėlių. Jacoby-Daniel prietaiso vario plokštelė dedama į vario sulfato tirpalą (vario elektrodas), o cinko plokštelė panardinama į cinko sulfato tirpalą (cinko elektrodas). Cinko elektrodas į tirpalą išskiria katijonus, todėl jame susidaro teigiamo krūvio perteklius, o vario elektrode tirpale katijonų nebelieka, todėl tirpalas įkraunamas neigiamai.
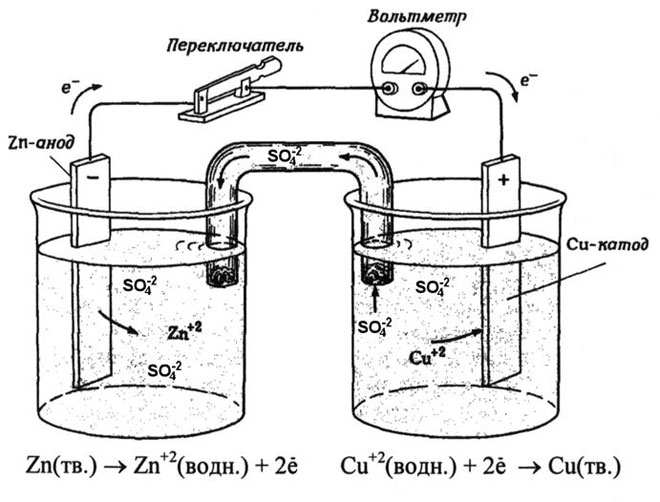
Užsidarius išorinei grandinei, elektronai iš cinko elektrodo teka į vario elektrodą. Pusiausvyros santykiai ties fazių ribomis nutrūksta. Vyksta redokso reakcija.
Savaiminės cheminės reakcijos energija paverčiama elektros energija.
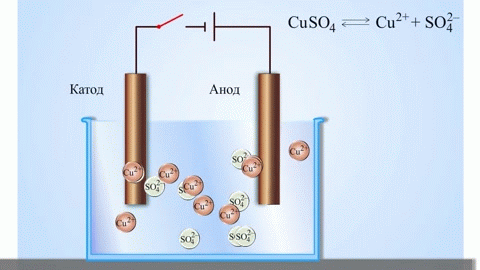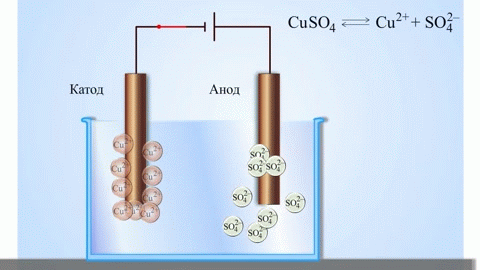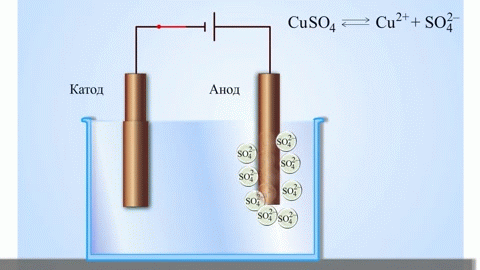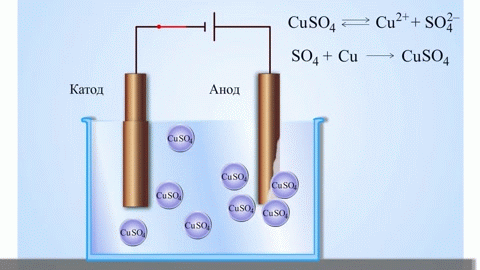
Jei cheminę reakciją sukelia išorinė elektros energija, procesas vadinamas elektrolize. Elektrolizės metu vykstantys procesai yra atvirkštiniai procesams, vykstantiems galvaninių elementų veikimo metu.
DĖMESIO! Elektrodas, ant kurio vyksta redukcija, taip pat vadinamas katodu, tačiau elektrolizės metu jis yra neigiamai įkrautas, o anodas - teigiamai.
Elektrocheminiai taikymai
Anodai ir katodai dalyvauja daugelyje cheminių reakcijų:
- Elektrolizė;
- Elektroekstraktavimas;
- Galvanizavimas;
- Galvanizavimas.
Išlydytų junginių ir vandeninių tirpalų elektrolizės metu gaunami metalai, metalai valomi nuo priemaišų ir išgaunami vertingi komponentai (elektrolitinis rafinavimas). Plokštės liejamos iš gryninamo metalo. Plokštelės dedamos į elektrolizatorių kaip anodai. Metalas ištirpinamas elektros srove. Jo katijonai patenka į tirpalą ir išsiskiria katode, sudarydami gryno metalo nuosėdas. Pirminėje neapdorotoje metalo plokštelėje esančios priemaišos arba lieka netirpios kaip anodinis dumblas, arba patenka į elektrolitą, kur yra pašalinamos. Varis, nikelis, švinas, auksas, sidabras ir alavas rafinuojami elektrolitiniu būdu.
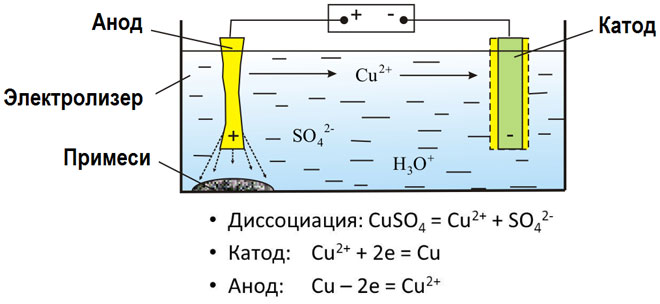
Elektroekstrakcija - tai metalo išgavimo iš tirpalo elektrolizės metu procesas. Norint metalą perkelti į tirpalą, jis apdorojamas specialiais reagentais. Šio proceso metu katode atskiriamas didelio grynumo metalas. Taip gaminamas cinkas, varis ir kadmis.
Siekiant išvengti korozijos, padaryti gaminį tvirtesnį ir dekoratyvesnį, vieno metalo paviršius padengiamas kitu. Šis procesas vadinamas galvanizavimu.

Elektroformavimas - tai trimačių objektų metalinių kopijų gaminimo procesas, kai metalas nusodinamas elektrolitiniu būdu.

Vakuuminės elektronikos taikymai
Vakuuminio prietaiso katodo ir anodo principą galima pademonstruoti naudojant elektroninį vamzdį. Atrodo kaip hermetiškai uždarytas indas su metalinėmis dalimis viduje. Prietaisas naudojamas elektriniams signalams ištiesinti, generuoti ir konvertuoti. Skiriama pagal elektrodų skaičių:
- diodai;
- triodai;
- tetrodai;
- pentodai ir kt.
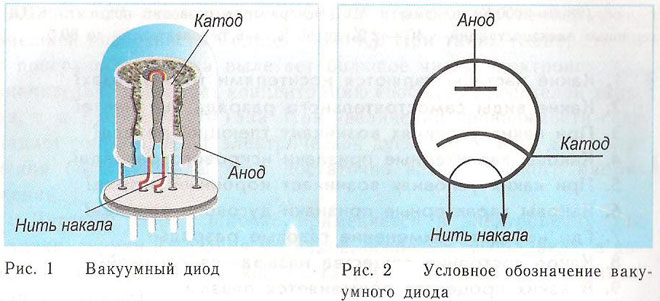
Diodas - tai vakuuminis prietaisas su dviem elektrodais - katodu ir anodu. Katodas prijungiamas prie neigiamo maitinimo šaltinio poliaus, o anodas - prie teigiamo poliaus. Katodo paskirtis - skleisti elektronus, kai jį iki tam tikros temperatūros įkaitina elektros srovė. Elektronai naudojami erdviniam krūviui tarp katodo ir anodo sukurti. Greičiausi elektronai veržiasi link anodo, įveikdami neigiamą erdvinio krūvio potencialo barjerą. Anodas priima daleles. Išorinėje grandinėje sukuriama anodinė srovė. Elektronų srautas valdomas papildomais elektrodais, kuriems suteikiamas elektrinis potencialas. Diodai naudojami kintamajai srovei paversti nuolatine.
Elektronikos programos
Šiandien naudojami puslaidininkiniai diodai.
Elektronikoje plačiai naudojama diodų savybė praleisti srovę tiesiogine kryptimi ir nepraleisti srovės atvirkštine kryptimi.
Šviesos diodo veikimas pagrįstas puslaidininkinių kristalų savybe švytėti, kai per p-n sandūrą teka srovė tiesiogine kryptimi.
Nuolatinės srovės galvaniniai šaltiniai - akumuliatoriai
Cheminiai elektros srovės šaltiniai, kuriuose vyksta grįžtamosios reakcijos, vadinami akumuliatoriais: jie įkraunami ir naudojami pakartotinai.

Veikiant švino rūgšties akumuliatoriui vyksta redokso reakcija. Metalinis švinas oksiduojasi ir atiduoda savo elektronus, redukuodamas švino dioksidą, kuris priima elektronus. Akumuliatoriuje esantis metalinis švinas yra anodas ir yra neigiamai įkrautas. Švino dioksidas yra katodas ir turi teigiamą krūvį.
Akumuliatoriui išsikraunant sunaudojamos katodo ir anodo medžiagos bei jų elektrolitas - sieros rūgštis. Norint įkrauti akumuliatorių, jis prijungiamas prie srovės šaltinio (pliusas prie pliuso, minusas prie minuso). Srovės kryptis dabar yra priešinga, nei buvo, kai akumuliatorius buvo iškrautas. Elektrocheminiai procesai elektroduose vyksta atvirkščiai. Dabar švino elektrodas tampa katodu, kuriame vyksta redukcijos procesas, o švino dioksidas - anodu, kuriame vyksta oksidacijos procesas. Akumuliatoriuje vėl sukuriamos akumuliatoriui reikalingos medžiagos.
Kodėl kyla painiava?
Problema kyla dėl to, kad tam tikras krūvio ženklas negali būti tvirtai prijungtas nei prie anodo, nei prie katodo. Dažnai katodas yra teigiamai įkrautas elektrodas, o anodas - neigiamas elektrodas. Dažnai, bet ne visada. Viskas priklauso nuo elektrode vykstančio proceso.
ĮSPĖJIMAS! Į elektrolitą įdėta dalis gali būti ir anodas, ir katodas. Viskas priklauso nuo proceso tikslo: uždėti kitą metalo sluoksnį ar pašalinti metalo sluoksnį.
Kaip nustatyti anodą ir katodą
Elektrochemijoje anodas yra elektrodas, kuriame vyksta oksidacijos procesai, o katodas - elektrodas, kuriame vyksta redukcija.
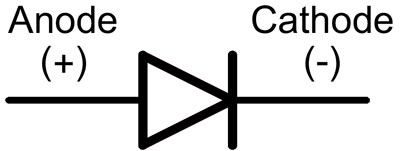
Diodo išvadai vadinami anodu ir katodu. Srovė tekės per diodą, jei anodo laidas bus prijungtas prie "pliuso", o katodo laidas - prie "minuso".
Naujo šviesos diodo su nenupjautais kaiščiais anodas ir katodas nustatomi vizualiai pagal ilgį. Katodas yra trumpesnis.

Jei kontaktai nupjauti, padės prie jų prijungtas akumuliatorius. Šviesa pasirodys, kai poliariškumas sutaps.
Anodo ir katodo ženklas
Elektrochemijoje teisingiau kalbėti apie procesus, vykstančius ant elektrodų, o ne apie elektrodų požymius. Redukcijos reakcija vyksta katode, o oksidacijos reakcija - anode.
Elektrotechnikoje katodas jungiamas prie neigiamo srovės šaltinio poliaus, o anodas - prie teigiamo poliaus.
Susiję straipsniai: