Klausimas, kas yra elektrolizė, aptarinėjamas nuo pat mokyklinio fizikos kurso ir daugumai žmonių nėra paslaptis. Kitas dalykas - jo svarba ir praktinis taikymas. Šis procesas puikiai naudojamas įvairiose pramonės šakose ir gali praversti namų meistrui.
Turinys
Kas yra elektrolizė?
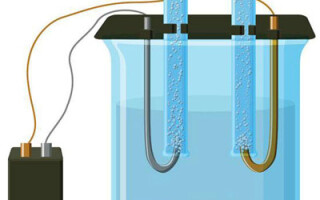
Elektrolizė - tai specifinių procesų kompleksas, vykstantis elektrodo ir elektrolito sistemoje, kuria teka nuolatinė elektros srovė. Jo mechanizmas pagrįstas joninės srovės susidarymu. Elektrolitas yra 2 tipo laidininkas (joninis laidumas), kurioje vyksta elektrolitinė disociacija. Tai apima skilimą į jonus su teigiamais (kation) ir neigiamas (anijonų) mokestis.
Elektrolizės sistemoje būtinai yra teigiamas (anodas) ir neigiamas (katodas) elektrodas. Veikiant nuolatinei elektros srovei, katijonai juda katodo link, o anijonai - anodo link. Katijonai daugiausia yra metalų jonai ir vandenilis, o anijonai - deguonis ir chloras. Katode katijonai įgyja elektronų perteklių, todėl vyksta redukcijos reakcija Men+ + ne → Me (kur n yra metalo valentingumas). Priešingai, anode elektronai atiduodami iš anijono ir vyksta oksidacijos reakcija.
Taip sistemoje užtikrinamas redokso procesas. Tačiau svarbu tai, kad šiam procesui reikia energijos. Ją turi užtikrinti išorinis srovės šaltinis.
Faradėjaus elektrolizės dėsniai
Didysis fizikas M. Faradėjus savo tyrimais ne tik leido suprasti elektrolizės prigimtį, bet ir atliko reikiamus skaičiavimus jai atlikti. 1832 m. pasirodė jo dėsniai, kurie susiejo pagrindinius vykstančių procesų parametrus.
Pirmasis dėsnis
Pirmasis Faradėjaus dėsnis teigia, kad anode redukuotos medžiagos masė yra tiesiogiai proporcinga elektrolite indukuotam elektros krūviui: m = kq = k*I*t, kur q - krūvis, k - medžiagos koeficientas arba elektrocheminis ekvivalentas, I - elektrolitu tekanti srovė, o t - srovės tekėjimo laikas.

Antrasis dėsnis
Antrasis Faradėjaus dėsnis leido nustatyti proporcingumo koeficientą k. Jis skamba taip: bet kurios medžiagos elektrocheminis ekvivalentas yra tiesiogiai proporcingas jos molinei masei ir atvirkščiai proporcingas jos valentingumui. Įstatymas išreiškiamas tokia forma:

k = 1/F*A/zkur F - Faradėjaus konstanta, A - medžiagos molinė masė, z - cheminis valentingumas.
Atsižvelgdami į abu dėsnius, galime išvesti galutinę formulę ant elektrodo nusėdusios medžiagos masei apskaičiuoti: m = A*I*t/(n*F)kur n - elektrolizėje dalyvaujančių elektronų skaičius. Paprastai n atitinka jono krūvį. Praktiniu požiūriu svarbu medžiagos masę susieti su naudojama srove, todėl procesą galima valdyti keičiant jos stiprumą.
Lydinių elektrolizė
Vienas iš elektrolizės variantų - elektrolitui naudoti lydalą. Šiuo atveju elektrolitiniame procese dalyvauja tik lydalo jonai. Klasikinis pavyzdys - druskos lydalo NaCl elektrolizė (valgomoji druska). Neigiami jonai veržiasi į anodą, todėl išsiskiria dujos (Cl). Katode vyks metalo redukcija, t. y. nusės grynas Na, susidaręs iš teigiamų jonų, kurie pritraukė perteklinius elektronus. Panašiai galima gaminti ir kitus metalus (K, Ca, Li ir kt.) nuo atitinkamų druskų ištirpimo.
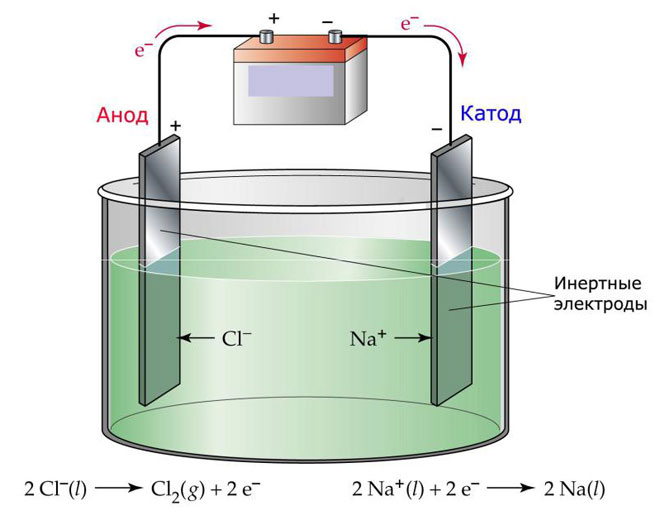
Lydomosios elektrolizės metu elektrodai netirpsta, o yra tik srovės šaltinis. Jiems gaminti gali būti naudojamas metalas, grafitas ir kai kurie puslaidininkiai. Svarbu, kad medžiaga būtų pakankamai laidi. Viena iš labiausiai paplitusių medžiagų yra varis.
Elektrolizės tirpaluose ypatybės
Elektrolizė vandeniniame tirpale gerokai skiriasi nuo lydalo elektrolizės. Šiuo atveju vyksta trys konkuruojantys procesai: vandens oksidacija, kurios metu išsiskiria deguonis, anijono oksidacija ir metalo anodinis tirpimas. Procese dalyvauja vandens jonai, elektrolitas ir anodas. Atitinkamai katode gali vykti vandenilio, elektrolito katijonų ir anodo metalo redukcija.

Galimybė vykti šiems konkuruojantiems procesams priklauso nuo sistemos elektrinio potencialo. Vyks tik tas procesas, kuriam reikia mažiau išorinės energijos. Todėl katode bus redukuojami katijonai, turintys didžiausią elektrodo potencialą, o anode oksiduojami anijonai, turintys mažiausią potencialą. Vandenilio elektrodo potencialas laikomas "0". Pavyzdžiui, kalio atveju jis lygus (-2,93 В), natris yra (-2,71 В), švino (-0,13 В), o sidabro - (+0,8 В).
Dujų elektrolizė
Dujos gali veikti kaip elektrolitas tik tuo atveju, jei yra jonizatorius. Šiuo atveju jonizuota terpe teka srovė, sukelianti reikiamą procesą elektroduose. Faradėjaus dėsniai netaikomi dujų elektrolizei. Tokios sąlygos yra būtinos jai įgyvendinti:
- Nepadeda nei didelė įtampa, nei didelė srovė, jei dujos nėra dirbtinai jonizuojamos.
- Elektrolizei tinka tik dujinės rūgštys be deguonies ir tam tikros dujos.
Svarbu! Procesas vyksta panašiai kaip elektrolizė skystame elektrolite, jei tenkinamos būtinos sąlygos.
Katode ir anode vykstančių procesų ypatybės
Norint praktiškai pritaikyti elektrolizę, svarbu suprasti, kas vyksta abiejuose elektroduose, kai naudojama elektros srovė. Būdingi šie procesai:
- Katodas. Teigiamai įkrauti jonai veržiasi į jį. Čia vyksta metalų redukcija arba vandenilio išsiskyrimas. Pagal katijoninį aktyvumą galima išskirti kelias metalų kategorijas. Tokie metalai kaip Li, K, Ba, St, Ca, Na, Mg, Be, Al gerai redukuojami tik iš išlydytų druskų. Jei naudojamas tirpalas, vandenilis išsiskiria elektrolizuojant vandenį. Šie metalai gali būti išgaunami tirpale, tačiau esant pakankamai katijonų koncentracijai - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Procesas lengviausias Ag, Cu, Bi, Pt, Au, Hg atveju.
- Anodas. Į šį elektrodą tiekiami neigiamai įkrauti jonai. Oksiduodamos jos atima elektronus iš metalo, todėl jos anodiškai tirpsta, t. y. Anijonai virsta teigiamai įkrautais jonais, kurie nukreipiami į katodą. Anijonai taip pat skirstomi pagal jų aktyvumą. Iš lydalų gali būti išskiriami tik anijonai PO4, CO3, SO4, NO3, NO2, ClO4, F. Vandeniniuose tirpaluose jie patiria ne elektrolizę, o vandenį su išsiskiriančiu deguonimi. Lengviausiai reaguojantys anijonai yra OH, Cl, I, S ir Br.

Vykdant elektrolizę svarbu atsižvelgti į elektrodo medžiagos polinkį oksiduotis. Skiriami inertiniai ir aktyvūs anodai. Inertiniai elektrodai gaminami iš grafito, anglies arba platinos ir nedalyvauja jonų tiekime.
Elektrolizės procesui įtaką darantys veiksniai
Elektrolizės procesas priklauso nuo šių veiksnių
- Elektrolito sudėtis. Didelę įtaką daro įvairios priemaišos. Jie skirstomi į 3 tipus - katijonus, anijonus ir organinius junginius. Medžiagos gali būti labiau arba mažiau neigiamos nei pagrindinis metalas, o tai trukdo procesui. Tarp organinių priemaišų yra teršalų (pvz., alyvos) ir paviršinio aktyvumo medžiagų. Jų koncentracijos yra didžiausios leistinos vertės.
- Srovės tankis. Remiantis Faradėjaus dėsniu, nusėdusios medžiagos masė didėja, didėjant srovės stiprumui. Tačiau susidaro nepalankios aplinkybės - koncentruota poliarizacija, padidėjusi įtampa, intensyvus elektrolito įkaitimas. Atsižvelgiant į tai, kiekvienu atveju yra optimalios srovės tankio vertės.
- elektrolito pH. Medžiagos rūgštingumas taip pat parenkamas atsižvelgiant į metalus. Pavyzdžiui, optimalus cinko pH yra 140 g/cc.
- Elektrolito temperatūra. Tai turi dviprasmišką poveikį. Didėjant temperatūrai, didėja elektrolizės greitis, tačiau kartu didėja ir priemaišų aktyvumas. Kiekvienam procesui yra optimali temperatūra. Paprastai ji būna 38-45 laipsnių.
Svarbu! Elektrolizę galima pagreitinti arba sulėtinti dėl įvairių poveikių ir pasirinktos elektrolito sudėties. Kiekvienai paraiškai taikoma skirtinga tvarka, kurios reikia griežtai laikytis.
Kur naudojama elektrolizė?
Elektrolizė naudojama daugelyje sričių. Galima išskirti kelis pagrindinius naudojimo būdus, kuriais galima pasiekti praktinių rezultatų.
Galvanizavimas
Plonas, tvirtas galvanines metalo dangas galima dengti elektrolizės būdu. Padengtas daiktas dedamas į vonią kaip katodas, o elektrolite yra norimo metalo druskos. Taip galite padengti plieną cinku, chromu arba alavu.

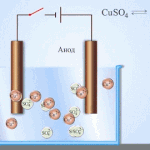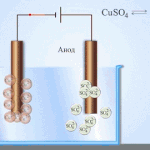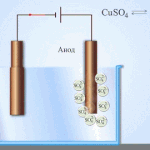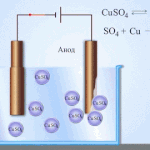
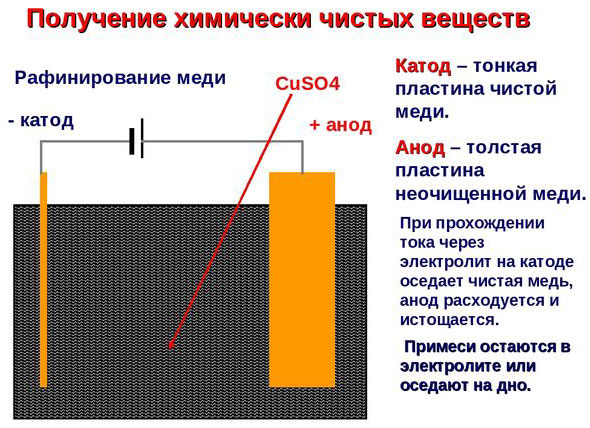
Elektrorafinavimas - vario rafinavimas
Elektrinio apdorojimo proceso pavyzdys katodas - grynas varis anodas - vario su priemaišomis, elektrolitas - vandeniniu vario sulfato tirpalu. Varis iš anodo virsta jonais ir nusėda katode be jokių priemaišų.
Metalų gavyba
Norint išgauti metalus iš druskų, metalai išlydomi ir po to lydalo tirpale elektrolizuojami. Šis procesas gana veiksmingas išgaunant aliuminį iš boksito, natrį ir kalį.

Anodavimas
Šio proceso metu danga gaminama iš nemetalinių junginių. Klasikinis pavyzdys - aliuminio anodavimas. Aliumininė dalis montuojama kaip anodas. Elektrolitas yra sieros rūgšties tirpalas. Dėl elektrolizės ant anodo nusėda aliuminio oksido sluoksnis, kuris turi apsauginių ir dekoratyvinių savybių. Šios technologijos plačiai naudojamos įvairiose pramonės šakose. Be to, procesus galima atlikti savo rankomis ir saugiai.
Energijos sąnaudos
Elektrolizei reikia daug energijos. Procesas bus praktiškai naudingas, jei anodinė srovė bus pakankama, o tam reikalinga didelė nuolatinė srovė iš maitinimo šaltinio. Be to, atsiranda šalutiniai įtampos nuostoliai - anodiniai ir katodiniai viršįtampiai ir nuostoliai elektrolite dėl jo varžos. Įrenginio naudingumo koeficientas nustatomas susiejant energijos sąnaudų galią su gautos medžiagos naudingosios masės vienetu.
Elektrolizė jau seniai efektyviai naudojama pramonėje. Anodavimas ir galvanizavimas tapo kasdienio gyvenimo kasdienybe, o medžiagų gavyba ir apdorojimas padeda išgauti daugelį metalų iš rūdos. Procesą galima suplanuoti ir apskaičiuoti žinant pagrindinius jo dėsningumus.
Susiję straipsniai: